News Center
我们调研超过30家医疗AI影像企业,2020年的产业发展方向在这里
来源:
|
作者:转载
|
发布时间: 2020-01-11
|
1852 次浏览
|
分享到:
假设2020年医疗人工智能打开了商业化道路,那么企业与企业之间抢夺市场的核心仍然是产品。
——审批。对于其中的大多数,这一问题让他们如鲠在喉——绝不致命,却又不能立即去除。
纵观2019年,在政策上给予AI支持的文件屈指可数。从全国层面上看,仅仅在6月29日药监局向AI企业发布了审批相关文件《深度学习辅助决策医疗器械软件审批要点》,以及10月30日国家发展改革委修订发布的《产业结构调整指导目录(2019年本)》两份文件中,明确提及了推动医疗人工智能发展。
医疗数据库的建立与完善一直在循序渐进。据悉,国家卫健委主导建立的医学影像数据库包括超声图像库(40个病种)、CT库、MRI库等,一些医院或企业单位都具有相当的规模。
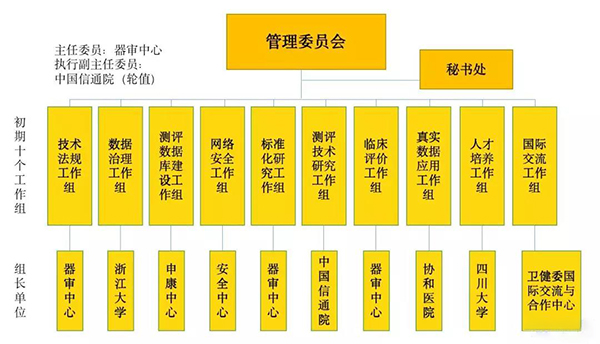
2019年7月15日,在《深度学习辅助决策医疗器械软件审批要点》发布后仅半月,国家药品监督管理局医疗器械技术审评中心联合中国信息通信研究院、上海申康医院发展中心、四川大学等众多机构成立了人工智能医疗器械创新合作平台,并确立建设至少包括CT肺、CT肝、 CT骨折、脑MRI、心脏MRI、冠脉CTA、心电、眼科8个项目的测试样本数据库。
纵观2019年,在政策上给予AI支持的文件屈指可数。从全国层面上看,仅仅在6月29日药监局向AI企业发布了审批相关文件《深度学习辅助决策医疗器械软件审批要点》,以及10月30日国家发展改革委修订发布的《产业结构调整指导目录(2019年本)》两份文件中,明确提及了推动医疗人工智能发展。
医疗数据库的建立与完善一直在循序渐进。据悉,国家卫健委主导建立的医学影像数据库包括超声图像库(40个病种)、CT库、MRI库等,一些医院或企业单位都具有相当的规模。
2019年7月15日,在《深度学习辅助决策医疗器械软件审批要点》发布后仅半月,国家药品监督管理局医疗器械技术审评中心联合中国信息通信研究院、上海申康医院发展中心、四川大学等众多机构成立了人工智能医疗器械创新合作平台,并确立建设至少包括CT肺、CT肝、 CT骨折、脑MRI、心脏MRI、冠脉CTA、心电、眼科8个项目的测试样本数据库。
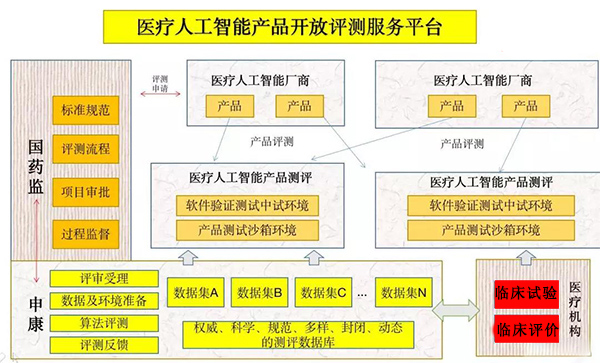
同时,国家药监局、申康中心等机构还打造了人工智能产品具体测评平台,其工作运行方式由下图所示。
但即便确认了审批流程及分工,临床试验这一环节依然卡住了不少企业。一方面是企业AI产品在临床表现不佳,另一方面则是临床本身需要大量时间。就放射科而言,即便是肺结节这样成熟的产品,想要通过审批,仍需在临床申报、临床试验上花上一定时间,其他产品则仍需继续打磨。
影像重建、影像增强类AI产品由于不涉及辅助诊断,仅需II类证便可实现销售,这类产品在商业化的进程之中快人一步。统计2018年1月至2019年9月数据,近40款AI产品通过了FDA审批,其中有一半的产品为非辅助诊断类产品。
例如,深透医疗(Subtle Medical)用于影像重建的AI平台SubtleMR;GE用于ICU的可移动智能X光设备重“症监护套件Critical Care Suite Optima XR240amx”均通过510(k)获得了FDA II类审批。
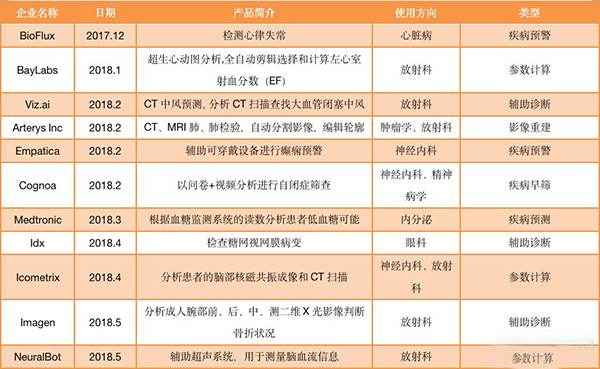
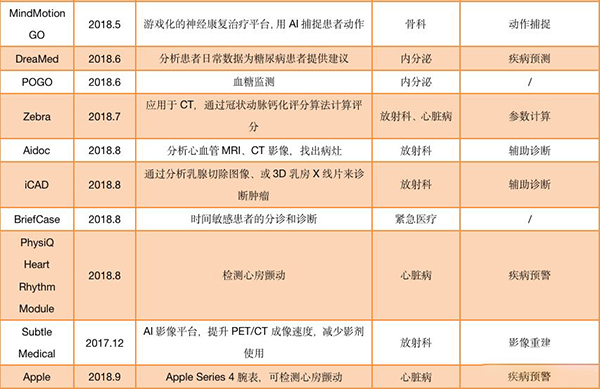
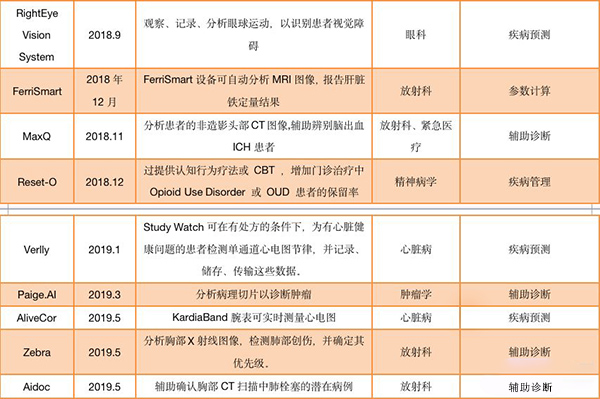

通过FDA审批的AI产品
(统计时间为2017年12月至2019年9月)
而在通过FDA的辅助诊断产品中,许多辅助诊断标签下的产品如Viz.ai、Imagen,它们的产品介绍中更多强调
